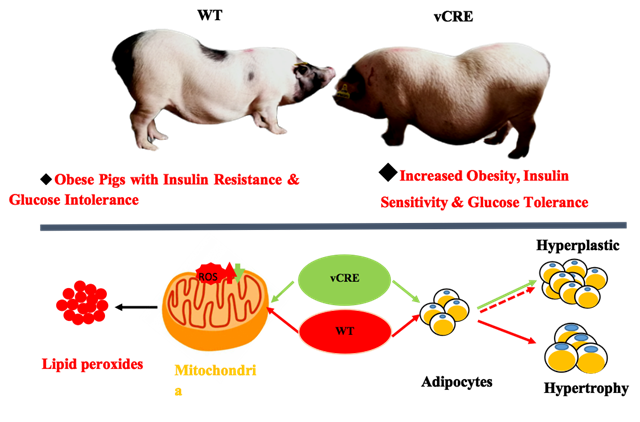
重点实验室培育出先天性过度肥胖但免于罹患糖尿病的猪模型
时间:2022-10-20
来源:广州健康院
时间:2022-10-20 来源:广州健康院
近日,中国科学院再生生物学重点实验室赖良学课题组在FASEB journal上在线发表了题为 Generation of a genetically modified pig model with CREBRFR457Q variant的研究论文。这项研究通过引入CREBRFR457Q突变成功建立了一种肥胖但不易得糖尿病的猪模型,并解析了CREBRFR457Q突变导致肥胖和降低糖尿病风险的机制。
众所周知,肥胖是导致2型糖尿病的重大风险因素。然而在萨摩亚、毛利人等人群中,肥胖率居于全球前列,但很少患2型糖尿病。调查发现,这些肥胖人群携带特有的CREB 3 regulatory factor基因变体, 即CREBRFR457Q。培育能够模拟表型相似实验动物模型,阐明其背后的机制,将为研发降低肥胖人群患糖尿病发生几率的药物提供有效靶标。国外学者建立了与人CREBRFR457Q同源点突变的小鼠模型,但小鼠模型并没有表现出肥胖表型、代谢相关指标的异常以及对2型糖尿病的保护作用。由于猪脂质代谢和胰岛结构等与人更为相似,本研究利用基因编辑和体细胞克隆技术,成功地培育了CREBRFR457Q点突变猪模型,并获得了可育后代。
CREBRFR457Q点突变猪表现出肥胖表型,其体重、腹围以及总体脂肪含量均高于野生型猪,并且脂肪积累主要在皮下,内脏脂肪积累不显著。与野生型的脂肪组织相比,点突变猪脂肪细胞数量多,体积小。体外脂肪分化实验也表明CREBRFR457Q变体促进前脂肪细胞分化。CREBRFR457Q导致的肥胖是由脂肪细胞数量增加(增生)而不是体积增大(过度增大)引起的,CREBRFR457Q点突变导致的肥胖在某种程度上是保护肥胖。血液生化分析表明该点突变在维持正常的胰岛素敏感性的基础上,上调了血液中的胰岛素水平。课题组进一步通过氧化水平的监测,发现该点突变能降低脂肪组织中氧化代谢能力、增强抗氧化能力,减少ROS的产生,从而降低氧化应激水平,以及由此带来的胰岛素抵抗等反应。本研究初步揭示了该点突变通过促进脂肪细胞生成导肥胖症,而通过降低氧化代谢、维持正常的胰岛素敏感性降低2型糖尿病风险的机制,为预防肥胖人群罹患糖尿病提供了新的思路。
该论文共同通讯作者为重点实验室樊娜娜副研究员和吴东海研究员。重点实验室的博士生李莹莹、陈晃耀、博士后汪海,广州健康院和安徽大学联合培养硕士生廖媛为共同第一作者。该研究得到了广东省科技计划、国家重点研发计划、中科院先导计划、广州市科技计划等多个项目的支持。
CREBRFR457Q点突变猪促进肥胖降低2型糖尿病的作用机制示意图