近日,英国癌症杂志 (British Journal of Cancer) 与英国癌症研究中心 (Cancer Research UK) 联合发表了中国科学院再生生物学重点实验室、广东省干细胞与再生医学重点实验室院李志远团队的最新研究成果《热应激参与TRPV2通过HSP70/27和PI3K/Akt/mTOR通路促进食管鳞状细胞癌的肿瘤发生》(Thermal stress involved in TRPV2 promotes tumorigenesis through the pathways of HSP70/27 and PI3K/Akt/mTOR in esophageal squamous cell carcinoma)。该研究首次发现, 瞬时受体电位离子通道香草素亚型2 (transient receptor potential vanilloid 2, TRPV2) 反复受热或激动剂作用可激活HSP70/27和PI3K/Akt/mTOR信号通路,在体外实验中可显著促进食管鳞癌细胞的恶性行为,在体内则可显著促进食管鳞癌的成瘤和扩散。这一工作不仅揭示了热敏型TRPV2通道在食管鳞癌发生发展过程中扮演的重要角色,也为食管鳞癌的防治提出新的方向。
食管癌是全球、也是我国高发的恶性肿瘤之一,据2020年国际癌症数据,全球超过一半的新发食管癌集中在我国,其在我国的发病率和死亡率列于全部恶性肿瘤的第5位和第4位,严重威胁我国居民的生命健康。食管癌主要包括腺癌和鳞癌 (ESCC),我国食管癌90%以上为鳞癌。食管癌确诊时多数已进展至中晚期,患者总体5年生存率不足20%。
已知食管癌的发病及进展与多基因异常有关,而外界环境因素,特别是高温饮食被认为是引起食管鳞癌的主要风险因素之一,高温饮食往往使得食管黏膜经受频繁、反复的热刺激,导致食管黏膜上皮细胞功能变异风险增加。实际上,高热刺激已被国际癌症研究署列为食管癌的二类病因之一,然而,目前对其内在分子机制仍知之甚少。
为此,李志远研究团队基于多年对瞬时受体电位离子通道 (TRP) 的研究基础,首先检测了热敏型TRPV在人食管鳞状上皮细胞的表达和功能,发现与非瘤组织相比,ESCC细胞和临床ESCC样本中的TRPV2表达均明显上调,钙成像实验证实其功能活动相应增强。
进一步研究发现,以激活TRPV2通道的热 (54°C) 对ESCC细胞进行短暂而频繁的刺激后,在体外实验中可明显增强ESCC细胞的增殖、侵袭和促血管生成等恶性细胞行为,而体内实验则可显著促进裸鼠皮下成瘤和尾静脉注射的肿瘤转移。使用TRPV2特异激活剂O1821作用于ESCC细胞后,也取得类似结果。反之, TRPV2拮抗剂Tranilast的应用或经CRISPR-Cas9方法敲除ESCC细胞的TRPV2基因后, 上述的ESCC致瘤作用均显著减弱。另外,将TRPV2 过表达于非瘤食管鳞状细胞NE2后,以热 (54°C) 和O1821对NE2细胞进行短暂而频繁的作用后可显著促进NE2的增殖,使其呈现侵袭性并在裸鼠皮下成瘤,说明过表达过激活的TRPV2可使非肿瘤细胞转向肿瘤化。
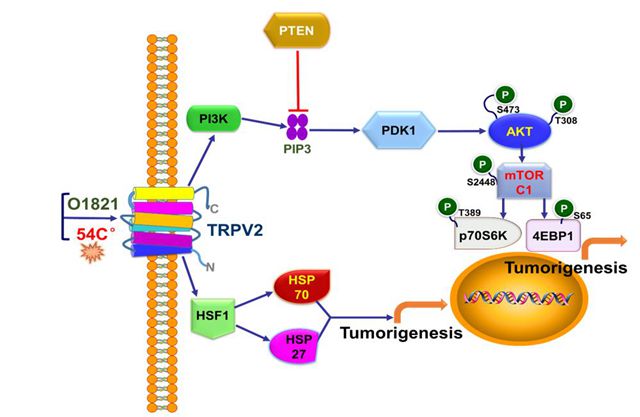
在机制上,TRPV2在ESCC细胞经热应激激活后可上调细胞的热休克因子1 (HSF1) 并促进热休克蛋白70和27 (HSP70/27) 的转录表达,从而促进ESCC的成瘤性;同时PI3K在此过程中显著激活,进而激活其下游信号蛋白PDK1,随后PDK1上调靶蛋白AKT1和mTORC1的功能,反之,PI3K的负调控蛋白PTEN受到下调抑制,说明PI3K信号被PTEN放大,从而显著促进ESCC的成瘤性和侵袭力。激活的TRPV2还上调Akt 蛋白的S473和T308位点的磷酸化水平,而p-mTOR (S2448)和效应蛋白磷酸化水平p-p70S6K (T389) 和p-4EBP1 (S65) 均相应提升,而Tranilast的应用或TRPV2基因敲除则抑制上述作用。
该研究还发现pan-PI3K/mTOR激酶抑制剂VS5584和Oroxin B可显著抑制TRPV2过激活的ESCC细胞增殖,两者与Tranilast合用可进一步削弱ESCC细胞的增殖能力,提示Tranilast联合pan-PI3K/mTOR抑制剂可能可用于ESCC的治疗。多因素生存分析提示TPRV2高表达是ESCC患者预后不良的独立因素,表明TRPV2有望成为ESCC不良预后的生物标志物和新的治疗靶点。
值得注意的是,该研究发现的TRPV2通道的激活温度54°C,低于许多人群中的膳食温度,也远低于国际癌症研究署建议的高温饮食风险温度 (65°C),因此,该研究为食管鳞癌的防治提出了新的方向。
热应激参与TRPV2促进食管鳞状细胞癌的肿瘤发生示意图
重点实验室的黄荣奇博士为该文的第一作者,李志远研究员为通讯作者。该研究工作不仅得到院外多家单位包括香港大学李嘉诚医学院、中南大学湘雅二院及湖南省肿瘤医院的支持,也得到院内包括李鹏、赖良学等多个研究组的协助。该研究获得了国家自然科学基金、广东省以及生物岛实验室前沿研究项目的资助。