重点实验室在利用患者来源的iPSCs建立多发性内分泌瘤疾病模型取得进展
时间:2022-08-05
来源:广州健康院
时间:2022-08-05 来源:广州健康院
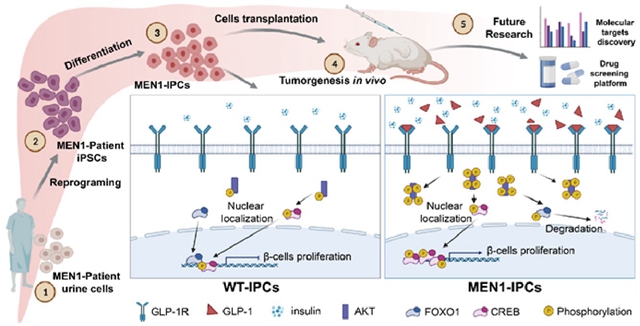
中国科学院再生生物学重点实验室李尹雄研究员课题组等通过收集多发性内分泌瘤I型(MEN1)病人尿液细胞重编程为诱导性多能干细胞(iPSCs),结合体外胰岛β样细胞分化和免疫缺陷小鼠移植实验,成功地再现了MEM1高胰岛素分泌这一的关键表型及其背后的机制,建立了MEM1的疾病模型,并发现GLP-1R通路是治疗由胰岛素瘤导致的高胰岛素血症的潜在靶点。相关工作近日在Cells科学期刊上以Modeling MEN1 with Patient-Origin iPSCs Reveals GLP-1R Mediated Hypersecretion of Insulin为题发表。
MEN1 是一种的罕见遗传病,MEN1基因突变导致多种内分泌器官和腺体(包括甲状腺、甲状旁腺、肾上腺和胰腺等)的肿瘤发生,其中胰腺内分泌肿瘤(PNETs)的发病率最高,其高胰岛素血症导致的低血糖昏迷是致命的。由于MEN1突变位点众多,其编码蛋白的功能复杂,相同基因型的MEN1小鼠模型,出现不同的表型,其基因型和表型的关系存在不确定性;而且,人类的胰腺和啮齿类的胰腺存在结构和生理上的较大差异;因此,基于患者iPSCs的基因型和表观遗传记忆构建MEN1疾病模型,有望克服单纯的小鼠基因操作存在的基因型-表型不统一的缺陷。
课题组通过收集一个MEN1家庭中母子两位患者的尿液,建立了重编程细胞株(iPSCs),在MEN1-iPSC分化的胰岛β样细胞阶段,重现高胰岛素分泌的临床表型。该表型的基础是MEN1细胞从胰祖细胞阶段开始,表现出强大的增殖能力,产生大量的胰岛β样细胞,导致高胰岛素分泌。探究其病理机制,发现受MEN1负调控的胰高血糖素样肽-1(GLP-1)的分泌上调,通过结合GLP-1R,激活PI3K/AKT信号传导,改变了调控β细胞增殖两个关键转录因子FOXO1和CREB的磷酸化,导致FOXO1和CREB的比例失衡,引起 MEN1来源胰岛素阳性细胞的高增殖和高胰岛素分泌。GLP-1R或PI3K的抑制剂可以逆转这种表型,阐明GLP-1R是导致MEN1胰腺内分泌瘤的高胰岛素血症的病理关键和潜在的治疗靶点。
进一步免疫缺陷小鼠移植实验发现,不同干细胞阶段的MEN1细胞不能成瘤,只有移植MEN1胰岛β样细胞才可以形成肿瘤,并表达与患者原位肿瘤一致的PNETs标志物。提示iPSCs不仅保留了患者的基因型,同时还维持了其时空的表观记忆能力。基于患者iPSCs构建的MEN1 疾病模型,克服了基因型和表型不确定的缺陷,为深入探究分子病理和药物研发提供了理想的MEN1疾病模型。
MEN1病人来源的iPSCs建立MEN1疾病模型及其相关机制示意图
重点实验室博士研究生程子淇为该研究论文的第一作者,李尹雄研究员为通讯作者。本项研究的合作单位为广州复大医院。该研究获得了国家重点研发计划基金、国家自然科学基金、广东省基础与应用基础研究基金等的支持。