重点实验室揭示启动胚胎干细胞分化的表观遗传调控机制
中国科学院再生生物学重点实验室、广东省干细胞与再生医学重点实验室刘晶课题组与西湖大学裴端卿课题组合作揭示了染色质重塑复合物BAF和组蛋白修饰H3K27ac通过调控染色质可及性变化影响cJUN驱动的胚胎干细胞分化,该成果6月16日以H3K27ac mediated SS18/BAFs relocation regulates JUN induced pluripotent-somatic transition为题在线发表于Cell & Bioscience杂志上。
团队早期发现原癌基因cJUN可快速诱导多能性状态的退出(Jing Liu et al.,Nature Cell Biology,2015),8h cJUN的诱导可以驱动90%以上胚胎干细胞走向不可逆的分化,通过基于CRISPR/Cas9的全基因组基因敲除的遗传学筛选发现了染色质重塑复合物BAFs(Brg/Brahma-associated factors)的亚基SS18通过本身相分离性质显著调控干细胞分化(Junqi Kuang et al.,Nature Communications,2021)。
利用cJUN驱动的快速高效的分化系统,研究人员发现8h cJUN的表达引起了染色质可及性的动态变化,体现在多能性位点的关闭和体细胞位点的开放,而染色质重塑复合物BAF在分化过程中从多能性位点转移到体细胞位点,敲降BAF核心亚基Brg1显著的阻碍了cJUN过表达带来的染色质开放。此外,多种组蛋白修饰在分化过程中也发生了重定位,其中H3K27ac的识别影响BAF复合物在cJUN驱动的分化过程中的定位变化从而影响cJUN驱动的分化进程。
该研究建立了染色质重塑复合物、组蛋白修饰和转录因子协同调控细胞命运转变的模型,从多维层面揭示了细胞命运调控规律,为理解发育分化和肿瘤发生发展机制提供了借鉴,也为研究早期胚胎发育的关键事件及分子机制提供了简单高效的体外研究系统。
广州健康院重点实验室刘晶研究员和西湖大学裴端卿研究员为该论文的共同通讯作者,广州健康院重点实验室博士生林润霞、翟梓蔚和西湖大学博士后匡俊企为论文的共同第一作者。广州健康院重点实验室张小飞研究员和李轶副研究员对该工作进行了重要的指导和支持。本项工作得到了国家自然科学基金、国家重点研发计划,中国科学院“战略性先导科技专项”、中国科学院前沿科学重点研究项目、广东省科技计划项目、生物岛实验室前沿探索项目等的经费支持。
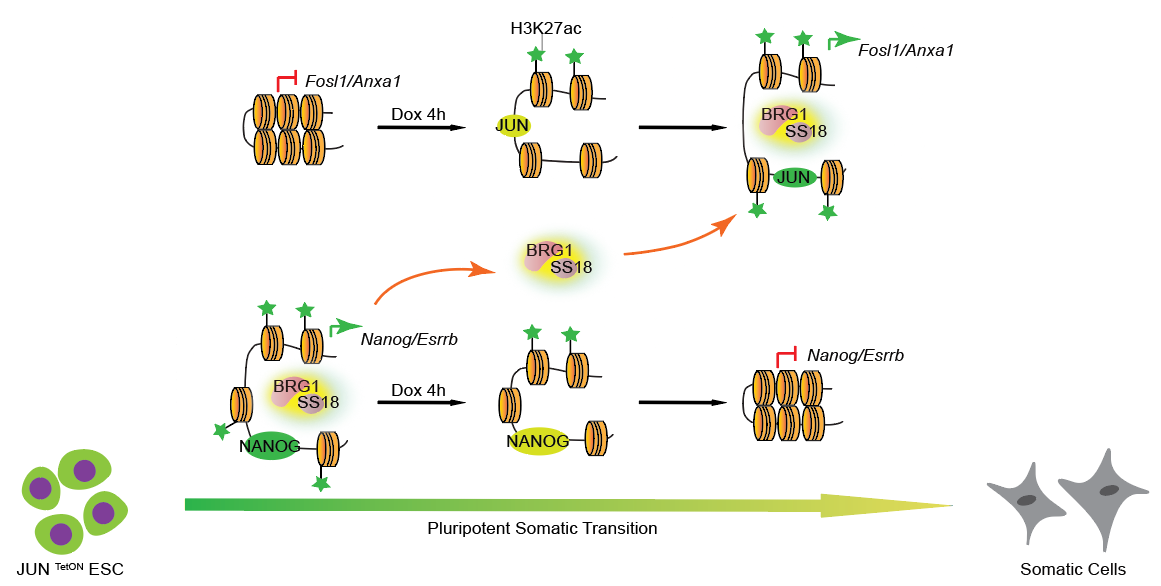
cJUN启动胚胎干细胞分化的表观遗传调控机制示意图