原发性肝癌(Primary liver cancer,PLC)是我国发病率和死亡率极高的恶性肿瘤。其发病分子机制复杂且尚未清楚。由于缺乏模拟人肝癌的研究模型,研究人员对人PLC发病分子机制和其治疗手段的研究仍然进展缓慢。近年来,肝脏人源化小鼠模型被广泛用于药物验证及癌症等领域的研究,如能够在人源化模型中将人原代肝细胞诱导为肝癌将有助于解开肝癌发生的关键分子机理和临床前药物验证模型等问题。
近日,中国科学院再生生物学重点实验室、广东省干细胞与再生医学重点实验室李鹏研究员和李尹雄研究员团队在EMBO Reports上发表题为Transforming primary human hepatocytes to hepatocellular carcinoma with genetically defined factors的研究成果,利用人原代肝细胞体内诱导了原发性肝癌模型并进行了应用。
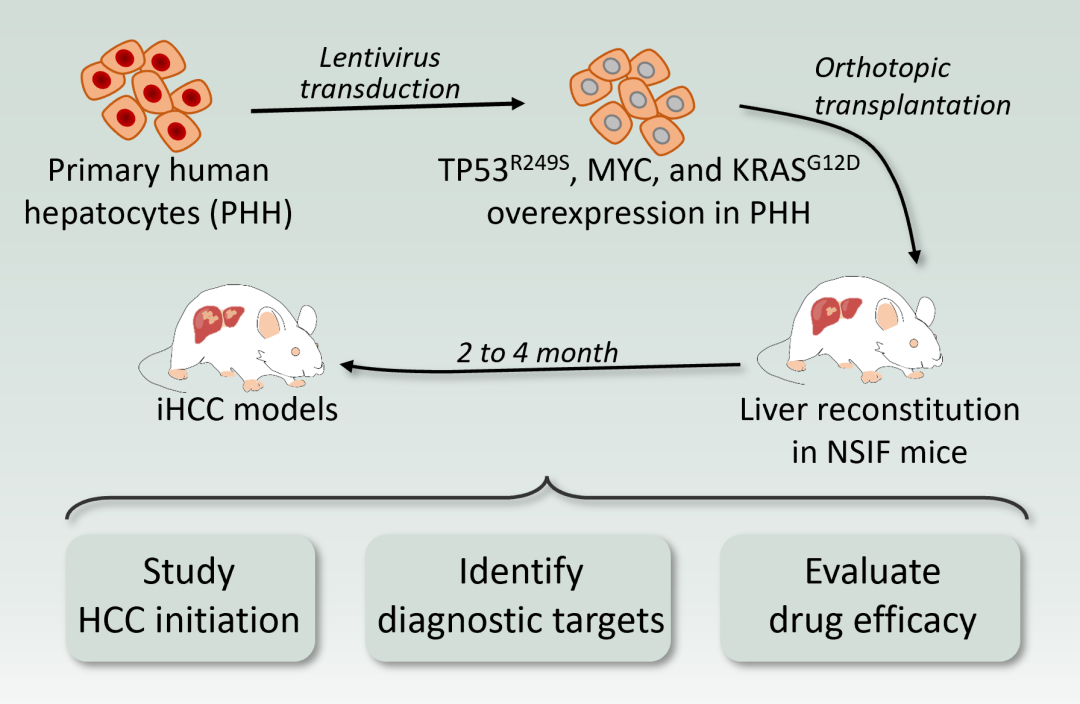
为筛选可直接诱导原代肝细胞为肝癌细胞的癌基因/突变抑癌基因组合,实验人员利用多基因混合转染的方式对原代细胞进行转染,并利用肝脏人源化小鼠模型进行体内筛选,最终发现发现诱导的肿瘤高表达MYC、TP53R249S和KRASG12D。免疫荧光结果显示,该类型肿瘤细胞高表达GPC3、AFP及CK19,但不表达EpCAM,证明利用该模型诱导的肿瘤为肝癌,即诱导型肝癌 (induced HCC)。进一步验证发现,MYC和TP53R249S联合表达即可诱导PHH在原位直接转化为肝癌 (iHCC),而KRASG12D可显著提高其致瘤率。生物信息分析发现,iHCC和临床HCC样本有相同的基因表达谱特征,且在连续移植后仍能够维持HCC的特性。
研究人员结合转录组分析发现MUC1和FAP在肝癌中高表达,而在正常肝脏中不表达。由此,分别制备了靶向MUC1和FAP的嵌合抗原受体 (CAR) T细胞,体外和体内杀伤结果显示这两种CAR-T细胞均能有效杀伤iHCC细胞,为肝癌的临床治疗提供了新的标志物和潜在的治疗靶点。最后,研究人员利用该模型获得的肿瘤细胞在体外及体内评估了MEK1/2抑制剂 (曲美替尼,Trametinib) 和CDK4/6抑制剂 (帕博西尼,palbociclib) 对肝癌的治疗作用。结果显示联合用药可有效诱导肝癌细胞进入衰老状态并最终死亡,为肝癌的临床治疗提供了新型治疗方案。本研究为探究肝癌发生发展提供实验和理论基础,诱导型肝癌(iHCC)模型可应用于发掘肝癌早期诊断标志物、筛选免疫细胞治疗的新靶点及评价肝癌药物的药效等转化研究。
该研究工作主要由广州健康院重点实验室蒋治武博士和生物岛实验室助理研究员程琳共同完成,中国科学院广州生物医药与健康研究院李鹏研究员和李尹雄研究员为本文共同通讯作者。该研究成果得到了国家重点研发计划、国家自然科学基金以及广东省重点研发计划等项目的资助。
重点实验室在原发性肝癌模型构建及其应用方面取得新进展
