重点实验室构建新型安全高效的单碱基基因编辑系统
近日,中国科学院再生生物学重点实验室赖良学研究员与五邑大学邹庆剑副教授团队合作首次将腺苷脱氨酶与转录激活因子样效应子(TALE)融合,开发了一种不会产生Cas9依赖性脱靶的新型碱基编辑系统TaC9-ABE。相关成果以Elimination of Cas9-dependent off-targeting of adenine base editor by using TALE to separately guide deaminase to the target site为题于3月24日在线发表在Cell Discovery杂志上。
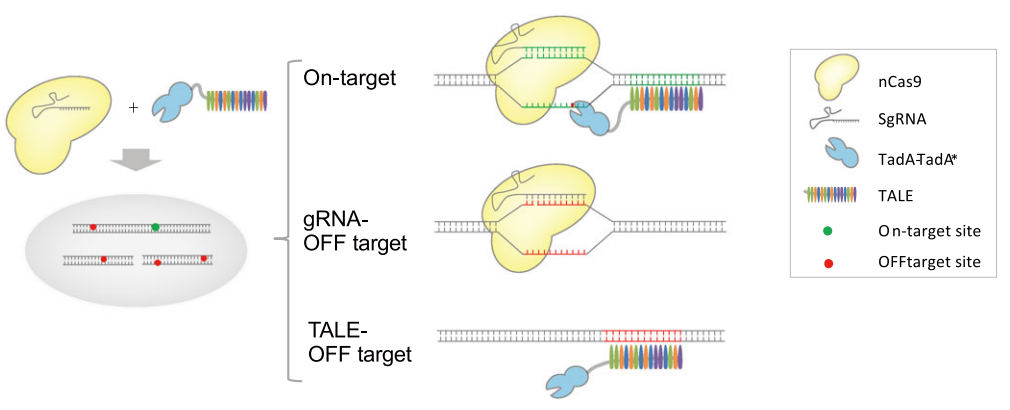
单碱基编辑技术能够在不产生双链断裂的前提下,对DNA的单个碱基进行替换,因而具有高效而又精确的基因编辑能力,可在动植物细胞内引入点突变,用于培育具有理想表型的基因编辑动植物,也可以对致病性点突变进行纠正,从而用于遗传疾病的基因治疗。其中,腺嘌呤单碱基编辑器,简称ABE,可以对目标位点实现高效腺嘌呤(A)到鸟嘌呤(G)的单碱基转换。传统的ABE是将nCas9和腺嘌呤脱氨酶融合形成的二聚体蛋白,由起导航作用的gRNA引导至靶位点发挥碱基替换作用。然而,gRNA对DNA序列的错误结合有一定的宽容性,可以在错误的基因位点形成脱靶编辑效应,从而为基因编辑动植物的培育和人类遗传性疾病的基因治疗带来安全隐忧。
在TaC9-ABE碱基编辑系统中,研究人员将nCas9与gRNA连接,而腺嘌呤脱氨酶与另一个具有导航作用的TALE相连接。nCas9在gRNA引导下,结合到目标DNA位点,打开并切割双链靶DNA形成单链DNA,同时,腺嘌呤脱氨酶在TALE引导下结合到相同的靶位点,脱氨酶即可对靶向链DNA进行编辑,实现靶位点的A到G突变。如果nCas9被gRNA带到错误的位点,由于没有脱氨酶的存在,A到G的转换就不能发生,同理,如果脱氨酶被TALE引导至错误的位点,由于没有nCas9的存在,不能形成单链DNA,脱氨酶发挥不了作用,A到G的转换也不能发生,这样就彻底地排除了发生Cas9依赖性脱靶的可能性。研究结果证实,TaC9-ABE碱基编辑系统在保证高效但碱基编辑的同时,对gRNA依赖的脱靶位点以及TALE依赖的脱靶位点进行深度测序均未检测到脱靶现象,而传统的ABE编辑器在大约50%的预测脱靶位点都发生了脱靶编辑。本研究为基因编辑动植物的培育和人类遗传性疾病的基因治疗提供了一个安全的单碱基编辑工具。
赖良学研究员和邹庆剑副教授为论文的共同通讯作者。健康院与中科大联合培养博士生刘洋、广东工业大学博士生周继曾、健康院博士生蓝婷和五邑大学周小青博士为论文共同第一作者。该项目得到来自科技部、中科院、国家自然基金委、广东省和广州市等项目经费支持。
重点实验室构建新型安全高效的单碱基基因编辑系统