10月28日,《自然-结构和分子生物学》(Nature Structural & Molecular Biology)在线以长文Article发表了刘兴国组的最新成果 “Phase separation drives the self-assembly of mitochondrial nucleoids for transcriptional modulation”(相分离驱动线粒体类核自组装以进行转录调节)。该研究发现线粒体基因组与其结合蛋白,利用生物分子最基础的自发聚集的相分离性质,调控线粒体类核的组装以及转录的复杂过程,构建了首个相分离调控线粒体基因组结构与功能的模型。
相分离(Phase Separation,也称相变)是生物大分子利用自身性质,自发聚集和组装的过程和机制。大量的无膜细胞器通过相分离形成类细胞器结构,从而募集生物反应组分,促进和调控生物反应的发生。更重要的是细胞核基因组的压缩、染色质区室化、和转录均受相分离的调控。线粒体是哺乳动物细胞内唯一具有自身遗传物质的细胞器。线粒体类核是线粒体基因组折叠并包装形成的特殊亚细胞器结构: 环状线粒体基因组,被线粒体“类组蛋白”— 线粒体转录因子 A (TFAM)折叠。然而一个基本科学问题是:线粒体基因组组装与转录的空间秩序如何实现?
该研究发现线粒体转录因子 A (TFAM)可以通过相分离聚集;同时TFAM结合线粒体基因组后,共相分离形成形成液滴状结构。一个有趣的现象,与线状DNA片段促进液滴生不同,TFAM与线粒体环状基因组所形成液滴大小均一,与体内尺寸一致。
线粒体转录是一个多步骤、多复合物转录机器,包括转录起始复合物、转录延申复合物以及终止复合物等组装接力的过程。刘兴国团队进一步发现线粒体转录的各个复合物都能被TFAM-线粒体基因组通过特殊的多相相分离所招募,尤其是线粒体转录聚合酶POLRMT,被募集在类核相分离的外层,形成壳层结构,但并不能进入TFAM-线粒体基因组的核心区球体。这种多相相分离既募集转录起始复合物,又控制转录进入等待(standby)状态。进一步,在转录延申复合物的共相分离调控下,打破多相相分离壁垒,转录聚合酶POLRMT进入核心区球体,组装延申复合物,并进行转录。最后通过另一重相分离募集转录终止复合物,终止或者抑制线粒体转录。
在线粒体长期进化中,线粒体基因组进化出既不同于古细菌的单转录酶完成转录的简单方式,也不同于细胞核复杂调控的特殊路径。虽然已有的研究解析了线粒体转录的多转录复合物结构,然而与线粒体组装与转录机器匹配的模型一直尚待发现。本研究构建了线粒体类核相分离调控组装与转录的全新模型,通过“大道至简”而且保守的相分离的机制,串联了线粒体类核组装以及转录调控的各个过程。本发现是线粒体遗传的中心法则的理论进展,进一步完善了线粒体遗传信息的传递过程和机制,而且因为线粒体基因组在发育、衰老、遗传、肿瘤等中的重要作用,本发现具有重要的生理病理意义。
所有真核生物的能量源泉来自线粒体基因组的组装与功能,线粒体与细胞核在亿万年进化中“相遇相知相怜爱”,线粒体基因组以其半自主性,“半人半我半自在”,与细胞核相依存。“敢问呼吸源何处?为有卿卿相变来”,线粒体的核酸与细胞核的蛋白的相变诠释了呼吸之源。
本研究与清华大学、南方科技大学、北京大学、香港中文大学等合作完成的,获得国家重点研发项目、中科院、国家自然科学基金、广东省和广州市的经费支持。
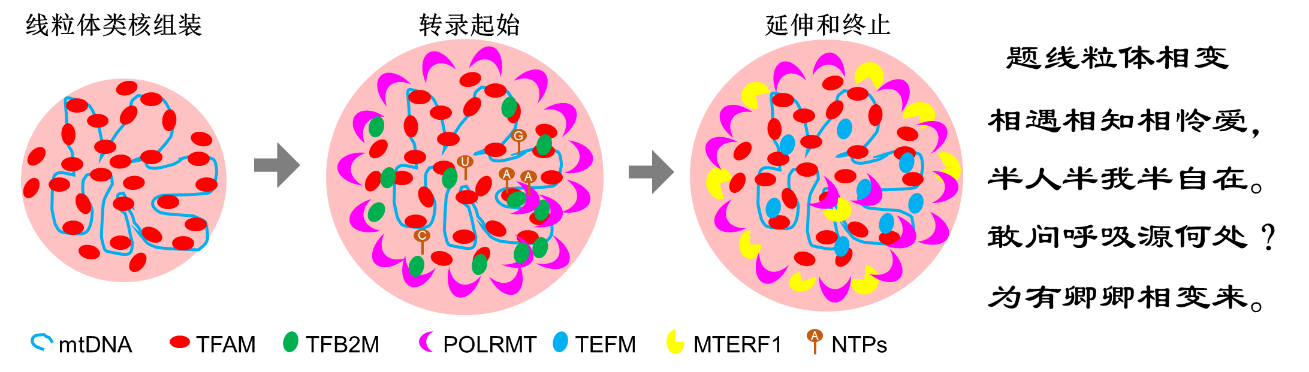
线粒体类核自组装及转录的多相相分离模型
