重点实验室在泛素化研究取得新进展
泛素化是指泛素(一类低分子量的蛋白质)分子在一系列特殊的酶作用下,将细胞内的蛋白质分类,从中选出靶蛋白分子,对靶蛋白进行特异性修饰的过程。泛素化在蛋白质的定位、代谢、功能、调节和降解中起着重要的作用,同时也参与了细胞周期、增殖、凋亡、分化、转移等几乎一切生命活动的调控。泛素化与肿瘤、心血管等疾病的发病密切相关。作为近年来生物化学研究的一个重大成果,泛素化成为研究、开发新药物的新靶点。
近日,受Nature Protocols杂志邀请,中国科学院再生生物学重点实验室张小飞研究组与荷兰内梅亨大学共同发表了一篇系统鉴定泛素相互作用蛋白研究方法的指南论文。根据与蛋白质底物连接的蛋白分子数量和拓扑结构,泛素化分为单泛素化、多位点单泛素化和多聚泛素化,其中同型多聚泛素化又可能细分为8个亚型。现阶段,人们对于细胞是通过哪些泛素,结合蛋白识别不同类型的多聚泛素化,仍处于个案研究,缺少系统性。
近年来,张小飞研究组与荷兰内梅亨大学、荷兰莱顿大学开发了一种泛素相互作用亲和富集-质谱(简称“UbIA-MS”)的方法。该方法可以全面快速鉴定来自细胞裂解液中所有泛素链的相互作用蛋白。相关的研究首先发表在Molecular Cell杂志上并受到同期杂志评论文章的高度评价。其评论文章指出,“这篇文章建立了一个新的用于研究泛素化信号通路的技术并且提供了一系列特异的二聚泛素链的相互作用蛋白。他们现在展示质谱技术也可以用于系统地鉴定泛素信号的特异相互作用蛋白。这项新技术和新发现的泛素相互作用蛋白将会促进泛素信号研究领域的发展。”
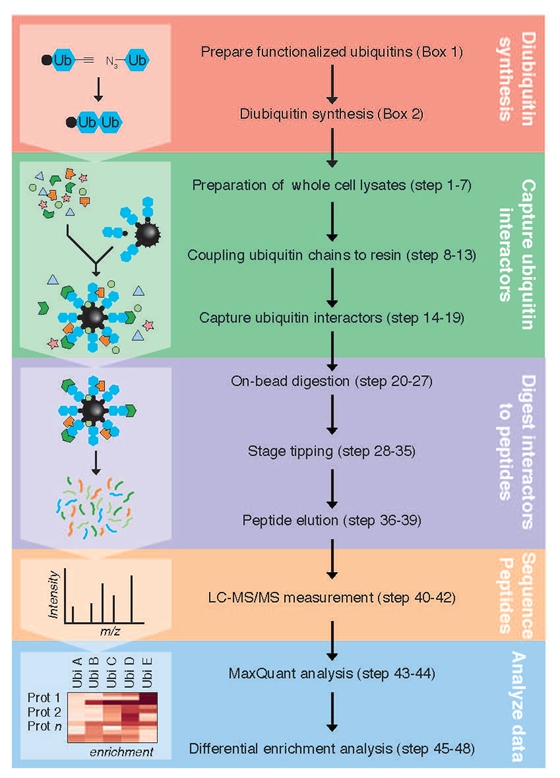
而在本次论文中,张小飞研究组与荷兰内梅亨大学共同发表了一篇详细介绍该方法的指南。论文介绍,UbIA-MS方法分为五个步骤。首先,点击化学合成不被去泛素化酶水解的泛素链;其次,体外亲和并纯化与泛素相互作用的蛋白;再次,将与柱子相互作用的蛋白消化为多肽;然后,运用液相色谱(LC)-质谱MS / MS进行分析;最后,通过数据分析以鉴别富集的蛋白质的差异。
这一方法优势是从原始的细胞裂解物中富集广泛的相互作用蛋白,这些内源表达的蛋白含有生物学相关的翻译后修饰并且以蛋白质复合物的形式存在。另外,运用这种方法,使用的化学合成的不可水解的二聚泛素体,其模拟天然的二聚泛素体不会被内源行去泛素化酶(DUB)切割断裂。
这一技术的应用将可以有助于深入地分析细胞是如何区分不同类型的泛素化修饰。同时,该篇指南论文提供的数据分析软件,可以用于快速地分析其他蛋白质谱相关数据,同时给出出不同类型的数据图表。
研究工作获得广东省科技厅的项目资助等。
泛素相互作用蛋白研究方法