重点实验室合作阐明基因组中转座元件的关键调控机制
中国科学院再生生物学重点实验室陈捷凯课题组与南方科技大学Andrew P. Hutchins课题组合作,以小鼠胚胎干细胞为模型,揭示了基因组中转座元件的关键表观遗传调控机制,相关成果以“Transposable elements are regulated by context-specific patterns of chromatin marks in mouse embryonic stem cells”为题于2019年1月3日发表在国际学术期刊Nature Communications上。
人基因组中,总共含有30亿对碱基,但仅有极少部分能够编码成蛋白质,而接近一半的序列由转座子组成,小鼠基因组中也基本类似。转座子最早在玉米基因组中被发现,并证明通过“跳跃”调控玉米粒的颜色。转座子与常规的基因相比,由于其重复序列和多拷贝的特性,一直以来是科学研究的难点,直至目前科学家们关于转座子的功能仍知之甚少,所以转座子又被称为基因组中的“暗物质”。为了阻止这些转座元件在基因组中四处移动造成遗传突变,基因组进化出相应的表观遗传机制使转座子的跳跃活性受到抑制。在这之前科学家们知道H3K9me3、H3.3以及DNA甲基化修饰参与了特定类型转座子的调控,但基因组中有上千种不同的转座子分布在数百万个不同的拷贝上,对每一类特定转座子在具体分子机制上如何起作用之前的研究仍不清楚,这一研究为科学家们仍然在不断探索的这方面的知识做出了重要补充。
胚胎干细胞是科学家们用来研究染色质动态变化与基因表达调控的常用的细胞模型,相比于分化的细胞,胚胎干细胞具有更强的可塑性,具备分化成生物体内成百上千种不同细胞类型的能力。科研人员通过分析小鼠胚胎干细胞中组蛋白修饰、DNA修饰以及染色开放程度的数据,发现大部分转座子序列上包含有多种不同的表观遗传修饰共同作用调控模式,这主要发生在由远古病毒感染残留的逆转座子上,又称为内源性逆转录病毒(ERV)。该研究发现,部分ERV元件与之前报道的结果一样,受到H3K9me3和H3.3的调控。但大部分ERV元件除了这两种修饰以外,还存在多种如H4K20me3、H3K27me1、H2A.Z、H4R3me2等修饰,并且在某些ERV元件存在以上基因沉默相关修饰外,同时还存在H3K4me1、H3K4me3、H3K27ac、H3K56ac、H3K9K14ac等常规认为与基因激活相关的表观遗传修饰,该研究首次揭示了沉默型的表观遗传修饰和激活型的表观遗传修饰可以在同一个转座子上共存,研究团队将这类转座子命名为“多标转座子”。通过表观遗传修饰对应其表观遗传修饰酶,研究团队发现敲低Nocr2、Rnf2、Prmt5、Hdac5、Uhrf1、Rrp8、Ash2l、Kat5等的细胞中转座子元件变得更加活跃。该研究同时还发现,敲低Rnf2、Brd7、Hdac5的细胞激活了2细胞期特异性基因表达网络,说明这些表观遗传酶的敲低可能更利于胚胎干细胞往2细胞期重编程。
该研究系统揭示了小鼠胚胎干细胞中表观遗传修饰调控转座子活性的具体机制,并为胚胎干细胞向2细胞期重编程提供了新的思路。
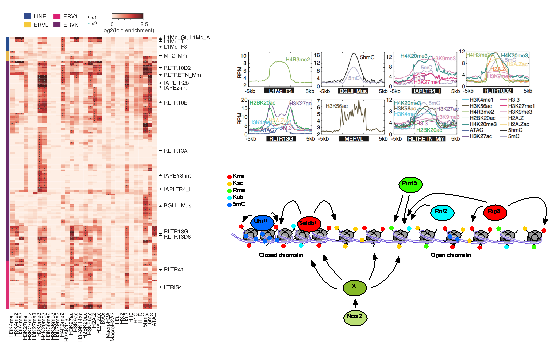
胚胎干细胞中转座子活性调控模型