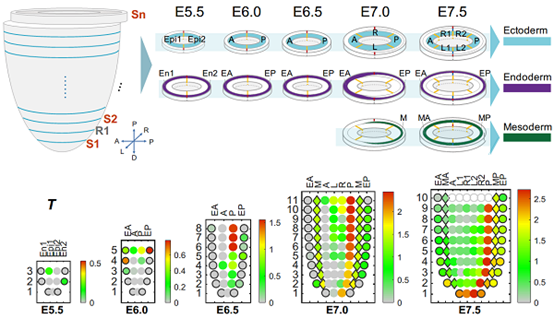
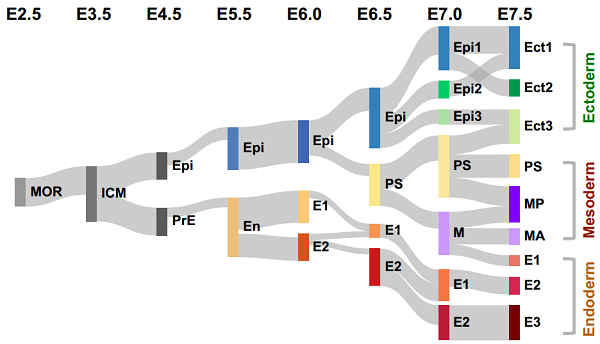
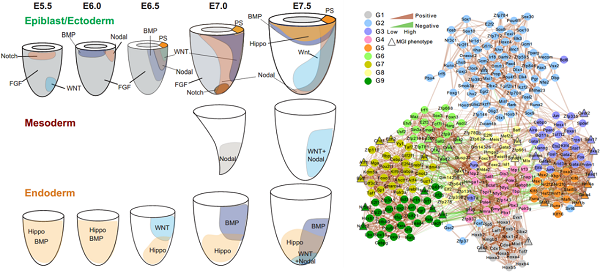
为了探索胚层谱系建立过程中的关键信号分子,研究者进行了信号通路富集分析。结合功能实验,首次发现Hippo/Yap信号通路在内胚层谱系发生过程中具有重要作用。同时也找到了许多在胚层谱系发生过程中关键的转录因子。这项工作系统全面地绘制了早期胚胎发育过程中,谱系建立的关键信号调控网络,这将大大推动发育生物学和干细胞生物学对细胞命运抉择的认识,加深对生命运行机制的理解。
图3. 胚层关键信号作用区域及关键转录因子调控网络
绘制了小鼠胚胎E5.5-E7.5时期外、中、内三胚层的关键信号通路作用区域;不同颜色代表不同组的转录因子;棕色连接线代表正相关,绿色连接线代表负相关,连接线的粗细代表相关程度;MGI数据库中敲除小鼠表型与原肠运动异常的标注为三角符号。
本研究主要由中国科学院分子细胞科学卓越创新中心/生物化学与细胞生物学研究所景乃禾课题组、中国科学院-马普学会计算生物学伙伴研究所韩敬东课题组与中国科学院再生生物学重点实验室彭广敦课题组共同合作完成,中国科学院再生生物学重点实验室彭广敦研究员、中科院马普计算生物研究所索生宝博士、生物化学与细胞生物学研究所的崔桂忠博士和禹方博士为该论文的共同第一作者,景乃禾研究员、韩敬东研究员和彭广敦研究员为该论文的共同通讯作者。该工作得到了中国科学院动物研究所周琪研究员、悉尼大学Patrick P.L. Tam教授、生化与细胞所化学生物学技术平台、高性能计算存储与网络服务平台和动物实验技术平台的大力支持。这项工作得到了中国科学院战略性先导科技专项、国家重点研发计划、国家自然科学基金委员会、广东省科学技术基金、广州再生医学与健康广东省实验室前沿探索项目、上海市自然科学基金和上海市科学技术委员会的资助。
Reference:
1. Aibar, S., Gonzalez-Blas, C.B., Moerman, T., Huynh-Thu, V.A., Imrichova, H., Hulselmans, G., Rambow, F., Marine, J.C., Geurts, P., Aerts, J., et al. (2017). SCENIC: single-cell regulatory network inference and clustering. Nature methods.
2. Cao, J., Spielmann, M., Qiu, X., Huang, X., Ibrahim, D.M., Hill, A.J., Zhang, F., Mundlos, S., Christiansen, L., Steemers, F.J., et al. (2019). The single-cell transcriptional landscape of mammalian organogenesis. Nature.
3. Chan, M.M., Smith, Z.D., Grosswendt, S., Kretzmer, H., Norman, T.M., Adamson, B., Jost, M., Quinn, J.J., Yang, D., Jones, M.G., et al. (2019). Molecular recording of mammalian embryogenesis. Nature.
4. Chen, J., Suo, S., Tam, P.P., Han, J.J., Peng, G., and Jing, N. (2017). Spatial transcriptomic analysis of cryosectioned tissue samples with Geo-seq. Nature protocols 12, 566-580.
5. Nowotschin, S., Setty, M., Kuo, Y.Y., Liu, V., Garg, V., Sharma, R., Simon, C.S., Saiz, N., Gardner, R., Boutet, S.C., et al. (2019). The emergent landscape of the mouse gut endoderm at single-cell resolution. Nature.
6. Peng, G., Suo, S., Chen, J., Chen, W., Liu, C., Yu, F., Wang, R., Chen, S., Sun, N., Cui, G., et al. (2016). Spatial Transcriptome for the Molecular Annotation of Lineage Fates and Cell Identity in Mid-gastrula Mouse Embryo. Developmental cell 36, 681-697.
7. Pijuan-Sala, B., Griffiths, J.A., Guibentif, C., Hiscock, T.W., Jawaid, W., Calero-Nieto, F.J., Mulas, C., Ibarra-Soria, X., Tyser, R.C.V., Ho, D.L.L., et al. (2019). A single-cell molecular map of mouse gastrulation and early organogenesis. Nature.