北京时间2月24日,中国科学院再生生物学重点实验室郑辉课题组在国际学术期刊The EMBO Journal在线发表了题为Metabolic switch and epithelial–mesenchymal transition cooperate to regulate pluripotency的研究论文,该成果揭示了代谢模式与上皮间质转换协同调控体细胞重编程的新机制。
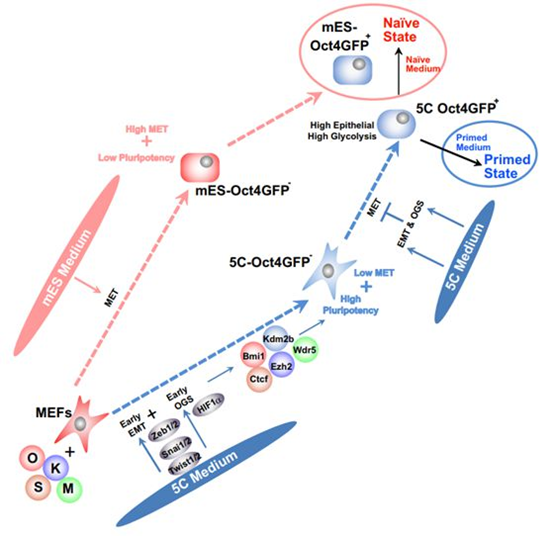
上皮和间质状态是两种主要的细胞状态。多细胞生物通过细胞在上皮和间质状态间反复的转换形成复杂的组织结构。大量研究表明上皮间质转换(EMT,epithelial-mesenchymal transition)和间质上皮转换(MET,mesenchymal-epithelial transition)参与多种生物学过程。早期的研究表明MET是成纤维细胞重编程早期的重要过程,而在正常的MET之前引入短暂的EMT可以有效提高重编程效率。这样的顺序性EMT-MET在多种细胞命运决定和转换过程中发挥重要作用,但是具体调控机制并不明确,都是需要深入研究的科学问题。
研究团队利用新型培养基(5C 培养基)在成纤维细胞重编程的早期诱导EMT,并证明早期EMT可以有效促进多能性重建的过程。早期EMT可以有效促进细胞能量代谢模式由氧化磷酸化向糖酵解的转变(OXPHOS-glycolysis switch, OGS);而在重编程早期利用小分子或者转录因子单独诱导OGS也可以观察到EMT。进一步的研究表明早期EMT与OGS通过下游关键转录因子之间的转录激活形成正反馈环路。在重编程早期,EMT和OGS通过下游关键转录因子共同激活一系列表观遗传调控因子,通过上调这些因子的表达进一步激活核心多能性转录因子的表达,有效促进多能性重建过程。研究团队随后在胚胎干细胞向肝脏细胞分化以及神经胶质细胞向神经细胞转分化过程也分别验证了早期EMT与OGS的相关性,以及两者对上述表观遗传调控因子的调控作用。在重编程后期,EMT与OGS共同作用将细胞重编程到一个新的多能性状态(5C state),基于公共数据库中的数据集,也可以观察到部分细胞具有与这样的新多能干细胞类似的基因表达谱,提示EMT与OGS的正反馈作用可能在早期胚胎发育以及多能性调控中发挥重要作用。此外,鉴于上皮间质间转换和能量代谢在肿瘤发生发展中的重要作用,这一研究成果或可以为肿瘤研究提供新的视角。
该研究得到了中国科学院战略性先导科技专项,中科院前沿科学重点研究计划,国家自然科学基金,广东省干细胞与再生医学重点实验室和广东省科技计划项目的资助。
代谢模式与上皮间质转换协同调控体细胞重编程的机制