4月9日,《细胞与发育生物学前沿》(Front Cell Dev Biol)杂志在线发表了中科院再生生物学重点实验室刘兴国课题组的最新研究成果“OPA1-Exon4b binds to mtDNA D-loop for transcriptional and metabolic modulation, independent of mitochondrial fusion”。该成果展示了一种OPA1外显子4b介导的不依赖于线粒体融合的全新线粒体功能修复机制,并进一步发现这一类剪接体在肝癌中有助于线粒体代谢转变。
细胞内的线粒体如同群居互助的小精灵,当个别线粒体出现损伤发生能量异常时,可以与其他功能正常的线粒体进行融合得到恢复。而融合的模式:短暂的“kiss-and-run”,抑或完全融合为一体,是由在内膜上的蛋白OPA1来决定的。OPA1如同线粒体社交的“情商”。然而,损伤的线粒体能否及怎样自我功能恢复呢?
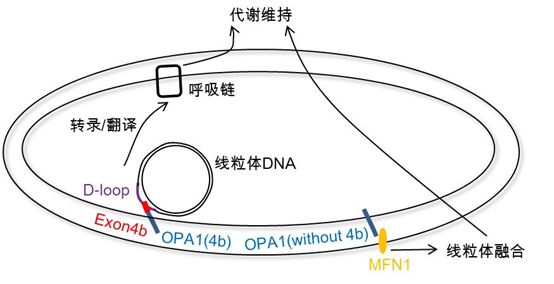
刘兴国组发现OPA1的外显子之一4b不依赖于线粒体之间的融合,直接调控线粒体呼吸而恢复自我能量供给。机制研究表明,OPA1外显子4b调控线粒体DNA类核的结构,特异结合线粒体DNA的D-loop区来调控其转录,修复电子传递链,最终恢复线粒体呼吸功能。更重要的是,含有OPA1-Exon4b的剪接体蛋白在肝癌细胞中的表达特异下调,导致肿瘤糖代谢Warburg效应中线粒体能量供给下降。
这一工作使人们对于OPA1在线粒体损伤中的作用有了一个崭新并全面的认识:当线粒体通过社交得到外援而功能恢复,OPA1不含外显子4b的剪接体发挥了“情商”的决定作用;当线粒体“心即是理”自我功能恢复,OPA1含外显子4b的剪接体发挥了“良知”的启动作用;当线粒体损伤严重将导致细胞死亡,OPA1则骤然“心碎” 释放内嵴的细胞色素c引发凋亡。这一多层次的调控模式不但在生理发育中发挥重要作用,而且调控了肿瘤等病理代谢转换。
本研究与武汉大学、中山大学、广州医科大学的多个研究组合作完成,获国家重点研发项目、中科院、国家自然科学基金、广东省和广州市的经费支持。
4OPA1调控线粒体自我功能修复新机制