基因表达调控是决定细胞命运的重要因素,通过改变基因的表达模式即可实现对细胞命运的精准调控。比如运用Yamanaka四个转录因子(Oct4, Sox2, Klf4, c-Myc)在体外就可将体细胞成功重编程为诱导多能干细胞。2020年6月10日,中国科学院再生生物学重点实验室/广州再生医学与健康广东省实验室姚红杰课题组联合清华大学生命科学学院孙前文课题组在国际学术期刊Science Advances在线发表了题为R-loops Coordinate with SOX2 in Regulating Reprogramming to Pluripotency的研究论文,该研究成果揭示了SOX2/Ddx5与R-loop协同调控体细胞重编程的新机制。
在基因转录过程中,会形成一种由单链DNA和DNA:RNA杂合链组成的三链核酸结构,称为R-loop。R-loop广泛存在于各个物种中,最早被认为是转录的副产物,但近年来发现R-loop在很多生物学过程中发挥着重要的作用。已有研究报道R-loop相关蛋白很多都是RNA结合蛋白(RBP),然而RBP如何协同R-loop在细胞命运决定中发挥作用尚不清楚。早在2017年,姚红杰课题组在国际学术期刊Cell Stem Cell已经揭示了RBP Ddx5通过调节miR-125b代谢从而负向调控PRC1复合物的非经典亚基RING1和YY1结合蛋白(RYBP)的双重功能,进而调控体细胞重编程为诱导多能干细胞。但是Ddx5作为RNA解旋酶在体细胞重编程中的功能仍然未知。
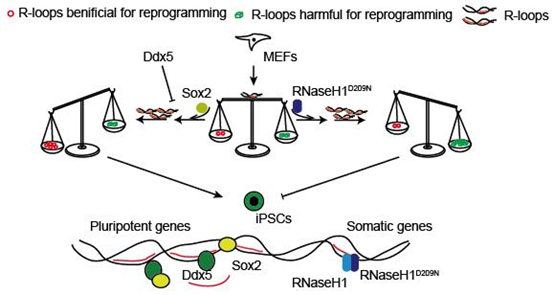
研究团队运用ssDRIP-seq技术,首先绘制了体细胞重编程过程中R-loop的动态变化图谱,发现R-loop并不是简单地作为转录的副产物出现,而是在转录发生变化之前就开始变化。根据R-loop的分布特点,结合多组学分析发现R-loop变化与染色质开放程度及增强子活性存在很高的正相关性,并与体细胞重编程过程密切相关。研究人员发现敲降R-loop的重要调控蛋白RNaseH1的表达可抑制体细胞重编程的进程。为了研究R-loop与体细胞重编程的关系,研究人员构建了RNaseH1突变体。体外实验表明RNaseH1酶活位点单个氨基酸的点突变体(RNaseH1D209N)可以显著抑制野生型RNaseH1对R-loop的消解作用。重编程实验表明RNaseH1D209N可以改变R-loop水平进而影响体细胞重编程的进程。
因子筛选实验表明Yamanaka四因子中只有Sox2可以回复因R-loop改变而被抑制的重编程。与对照组相比,过表达Sox2处理组中重编程细胞的R-loop水平更高。结合组学数据及生物信息分析发现Sox2结合位点附近的R-loop水平较高,而且在重编程过程中增加Sox2的表达量可以增加相关位点R-loop水平。结合RNA-seq及ssDRIP-seq数据发现Sox2促进多能性基因相关位点的R-loop富集。进一步生物信息分析发现Sox2调控的R-loop更倾向位于基因的启动子区域。
研究发现虽然Sox2可以与R-loop形成复合物,但EMSA实验结果表明Sox2并不具有直接结合R-loop的能力,而是间接参与调控R-loop水平的变化。为了揭示Sox2与R-loop的调控关系,研究人员通过质谱数据发现Sox2与RNA解旋酶Ddx5存在相互作用。体外R-loop消解实验揭示Ddx5解旋酶可以直接消解R-loop,而Sox2与Ddx5相互作用并抑制DDX5对R-loop的消解作用。研究还发现Sox2通过其DNA结合结构域(HMG区域)抑制Ddx5对R-loop的消解作用。
该研究进一步发现Sox2这一新功能并不依赖于Sox2的转录因子活性。体细胞重编程实验发现Sox2可回复因Ddx5而被抑制的重编程进程以及上调Ddx5相关调控位点的R-loop水平,进而促进体细胞重编程为多能干细胞。这项研究发现了Sox2/Ddx5协同调控R-loop参与体细胞重编程过程,阐明了R-loop对细胞命运调控的重要作用,并揭示了Sox2这一传统转录因子的新功能。
中国科学院再生生物学重点实验室/广州再生医学与健康广东省实验室姚红杰研究员与清华大学生命科学学院孙前文研究员为本文的共同通讯作者。姚红杰课题组博士生李尧益、宋亚威和孙前文课题组博士后徐炜、博士生李沁为本文共同第一作者。该课题的实施得到了来自中国科学院生物物理研究所薛愿超研究员和德国马普协会分子医学研究所Hans Scholer研究员的帮助。该工作得到来自国家重点研发计划干细胞专项、国家杰出青年科学基金、中国科学院战略性先导科技专项、广州再生医学与健康广东省实验室、清华-北大生命科学联合中心等项目经费的支持。
本研究的模式图