北京时间9月8日晚,中国科学院再生生物学重点实验室陈捷凯课题组在Cell Reports杂志在线发表了题为“YTHDF2/3 are required for somatic reprogramming through different RNA deadenylation pathways”的文章。该研究揭示了在体细胞重编程过程中,识别RNA m6A甲基化修饰的reader蛋白YTHDF2和YTHDF3通过不同的RNA降解途径协同调控体细胞中相关基因的降解,促进间质上皮转换(MET,mesenchymal-epithelial transition),从而利于重编程的顺利进行。
m6A(N6-甲基腺嘌呤)是真核生物mRNA转录后修饰中最常见、最丰富的化学修饰之一,该修饰由甲基转移酶复合体(METTL3、METTL14和WTAP等)、去甲基化酶(FTO和ALKBH5)和结合蛋白(YTHDF1/2/3、YTHDC1/2等)共同调控,参与到干细胞命运决定、胚胎发育等重要生理过程。早期的研究表明m6A在干细胞多能性的维持与分化、体细胞重编程中具有重要的作用,但在不同条件下的研究结论有所差别。这些差别可能是由于细胞命运变化过程中涉及的因素较多,同时m6A具有多个功能通路且作用于RNA稳定性这种全局层面所导致的。而针对m6A甲基化酶METTL3进行研究会影响到全转录组上的m6A水平,对不同m6A介导的通路都产生干扰。
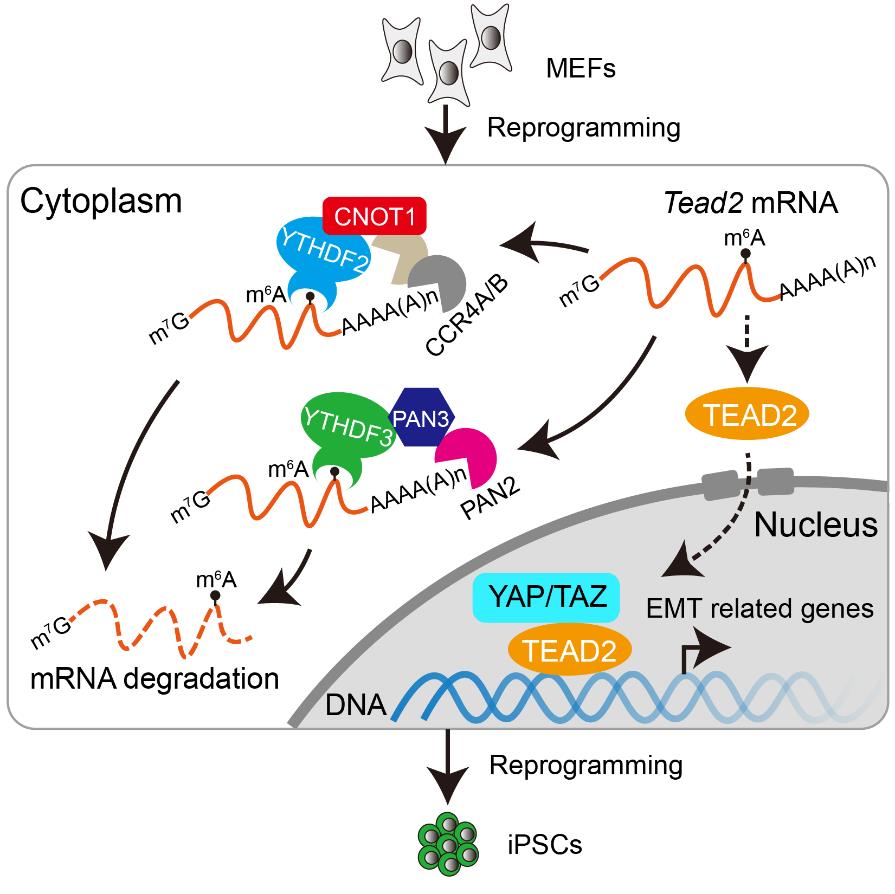
因此,为了更清晰地研究m6A在体细胞重编程中的作用,该研究主要关注功能相对单一的m6A结合蛋白YTHDF蛋白家族。研究结果表明,在体细胞重编程过程中敲降Ythdf2或Ythdf3都会抑制重编程,并且这种抑制作用是m6A依赖性的,而敲降Ythdf1则对重编程的效率基本上没有影响。进一步研究发现,YTHDF2通过招募CCR4-NOT脱腺苷化复合体调控体细胞重编程;而YTHDF3与PAN3具有相互作用,招募PAN2-PAN3复合体对mRNA进行脱腺苷化。在重编程过程中,YTHDF2-CCR4-NOT和YTHDF3-PAN2-PAN3这两条不同的mRNA降解途径协同促进体细胞相关基因mRNA的快速清除,有利于基因表达网络类型从体细胞向多能性干细胞转变。当其中任一途径受损,都会导致体细胞相关基因表达时间延长,从而损害重编程。
该研究还通过对敲降Ythdf2/3后mRNA半衰期延长的基因进行筛选,发现Hippo信号通路的效应因子TEAD2是其中一个重要的靶基因。TEAD2在重编程早期会结合并维持上皮间质转换(EMT,epithelial-mesenchymal transition)相关基因表达,过表达Tead2也会抑制重编程的效率。而敲降Ythdf2/3则会引起TEAD2结合的EMT相关基因表达上调,并且会促进细胞的迁移,说明敲降Ythdf2/3后会促进细胞发生EMT过程,使细胞不能正常进行MET过程而导致重编程效率被抑制。该研究还通过敲降Tead2或EMT相关基因Tgfb1等,可以使敲降Ythdf2/3导致下降的重编程效率恢复正常。
该研究利用体细胞重编程为模型,研究m6A结合蛋白YTHDF蛋白家族对细胞命运转变的影响,说明了YTHDF1/2/3在重编程中具有不一样的作用,并证实了YTHDF2和YTHDF3通过不同的RNA降解途径共同调控体细胞重编程,这一研究成果对理解m6A在体细胞重编程等细胞命运决定过程中的功能提供了新视角。
YTHDF2/F3通过不同的RNA降解途径共同调控体细胞重编程