10月8日,中国科学院再生生物学重点实验室秦宝明和Miguel A. Esteban课题组在Nature Communications杂志在线发表了题为“JMJD3 acts in tandem with KLF4 to facilitate reprogramming to pluripotency”的研究论文。
早前,团队(裴端卿、Miguel A. Esteban、王涛、秦宝明及其他成员)报道了维生素C(Vc)极大提高体细胞重编程效率,这一作用并非通过其经典的抗氧化活性,而是来自其抑制细胞衰老以及促进多能性相关基因的激活。根据以往有关Vc在干细胞以及细胞命运转变中的众多零散发现,研究人员推断Vc的这些丰富的作用很可能来自其作为二价铁的特异性还原剂,维持或激活一类二价铁和a酮戊二酸依赖的双加氧酶的活性,其中包括负责调控表观遗传的组蛋白和DNA去甲基化Jumonji家族和TET家族。后续团队是以Vc为有力工具,对这两类重要的表观遗传调控酶家族开展了一系列探索,先后报道了JHDM1B、KDM3/4和TET1等对重编程的作用和机制,大大增进了人们对甲基化修饰在细胞命运维持和转变中的作用和机制的认知。同时,更多新的表观遗传机制在细胞命运转变中的机制有待发现。
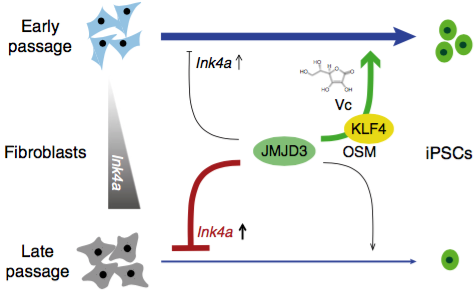
作为个体发育和干细胞分化中最重要的组蛋白修饰之一,H3K27me3标记发育分化基因并抑制其表达,在基因组水平H3K27me3的动态变化是发育和分化得以有序进行的重要基础。体细胞重编程是发育和分化的逆向过程,H3K27me3势必经历逆向的时空变化。此外,相当一部分多能性以及上皮相关基因在初始成纤维细胞中都被H3K27me3修饰,这些基因的激活伴随H3K27me3去甲基化。因此团队推断,H3K27me3的去甲基化可能是重编程必需的限速环节。
在哺乳动物中,负责H3K27me3的去甲基化酶主要有UTX(即KDM6A)和JMJD3(即KDM6B),除了非常相似的去甲基化酶活性结构域,两者在结构和功能都存在显著差异。以往研究报道,UTX是重编程中众多多能性相关基因激活所必需的,而JMJD3则通过2种途径抑制重编程,即激活细胞衰老以及降解多能性相关因子PHF20。这2项研究都是在没有Vc的条件下开展的,团队于是提出问题:在Vc条件下,JMJD3和UTX对重编程发挥怎样的作用?
团队发现,UTX与报道一致,而JMJD3对重编程则有2方面相反的作用。一方面,在传代后期出现衰老特征的小鼠胚胎成纤维细胞(MEF)中,与以往报道一致,JMJD3通过激活Ink4a/Arf抑制重编程,而且这一效应与重编程无关;另一方面,在传代早期年轻的MEF中,JMJD3提高重编程效率并且Vc能大大加强这一作用;在机制上,JMJD3被KLF4特异性地招募至上皮和多能性基因位点,并辅助KLF4激活这些基因。进一步,团队还在多种其他KLF4介导的细胞命运转变中验证了JMJD3的这一作用模式。因此,本研究对深入理解KLF4和JMJD3在相关发育、干细胞分化、生理和疾病条件下的复杂作用具有提示意义。
本研究在秦宝明和Miguel A. Esteban两位研究员共同指导下,由本重点实验室黄颖华博士和生物岛实验室张辉博士共同完成,并得到了来自南方科技大学Andrew P. Hutchins教授,吉林大学胡继繁教授,本重点实验室裴端卿、陈捷凯、潘光锦、赖良学、郑辉、鲍习琛等多位研究员,日本大阪大学Shizuo Akira教授,香港大学Ralf Jauch教授等众多同事和国内外同行的帮助和支持。在经费上,该工作得到了国家重点研发计划、国家自然科学基金、生物岛实验室、中国科学院再生生物学重点实验室、广东省干细胞与再生医学重点实验室、广东省和广州市科技计划等多个项目的支持。
重点实验室揭示H3K27me3去甲基化酶JMJD3与KLF4在体细胞重编程中协同调控转录的新机制